尼妥珠单抗联合卡瑞利珠单抗新辅助放化疗治疗初始不可切除食管鳞状细胞癌:一项单臂Ⅱ期试验
时间:2025-08-29
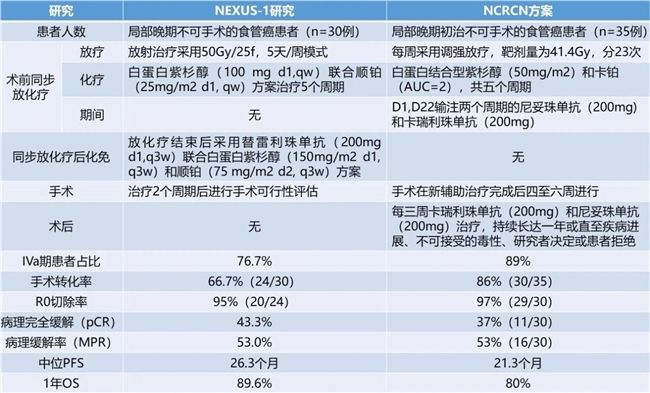
2025年8月,欧洲癌症杂志(European Journal of Cancer)发表文章《尼妥珠单抗联合卡瑞利珠单抗新辅助放化疗治疗初始不可切除食管鳞状细胞癌:一项单臂Ⅱ期试验》, 聚焦初始初始不可切除食管鳞状细胞癌患者,采用新辅助放化疗联合尼妥珠单抗和卡瑞利珠单抗(NCRCN)转化治疗,研究入组35例患者并接受新辅助治疗,中位年龄67(61-73岁),其中IVA期患者的比例89%,手术转化率达86%(30/35),其中R0切除率为97%(29/30);病理完全缓解率(pCR)和主要病理缓解率(MPR)分别为37%(11/30)和53%(16/30);中位观察时间18.5个月后,全队列1年无进展生存率(PFS)和总生存率(OS)分别为67%和80%。

研究背景
食管癌是全球癌症相关死亡的主要原因之一。根治性放化疗(CRT)已被提出作为初始不可切除的局部晚期食管鳞状细胞癌患者的标准治疗方案。其5年中位总生存期(OS)低于30%。此外,超过40%的患者在根治性CRT后出现局部复发,近30%出现远处转移失败。
一项回顾性研究比较发现,对于通过新辅助CRT降期的临床T4期食管癌,CRT-手术方案在延长总生存期(OS)和无进展生存期(PFS)方面优于根治性-CRT。因此,对于初始不可切除的患者,需要更有效、更全面且具有高手术转化率的策略。
研究设计
本研究是一项单臂、前瞻性、Ⅱ期试验。
入组标准:
1、年龄18-75岁;
2、初始不可切除(T4,临界可切除T3(侵犯气管、支气管或主动脉,影像学无法排除)伴不伴侵犯邻近器官的不可切除淋巴结转移,或经外科医生临床确认不可切除,且无远处转移证据(不包括锁骨上淋巴结转移));
3、经组织学证实的III-IVA期食管鳞状细胞癌;
4、ECOG体能状态0-1分;
5、预计生存期超过六个月;
6、足够的器官和骨髓功能(血常规、生化结果和心肺功能)。
主要排除标准:其他癌症病史、活动性自身免疫性疾病、未控制的肺部感染或其他严重合并症。
治疗方案:
患者接受同步放化疗,每周静脉注射白蛋白结合型紫杉醇(50mg/m2)和卡铂(AUC=2),共五个周期;在放化疗期间,于第1天和第22天静脉输注两个周期的卡瑞利珠单抗(200mg)和尼妥珠单抗(200mg);放疗每周规律进行,采用调强放疗,靶剂量为41.4 Gy,分23次完成。
手术计划在新辅助治疗完成后四至六周进行,手术后患者每三周接受额外的卡瑞利珠单抗(200mg)和尼妥珠单抗(200mg)治疗,持续长达一年或直至疾病进展、出现不可接受的毒性、研究者决定或患者拒绝。如果出现4级或更严重的不良毒性,则停止化疗。
主要终点是1年PFS率;次要终点是手术转化率、病理反应、2年PFS率以及1年、2年OS率。此外,探索性结局是生存获益与免疫细胞群之间的关联。
多重免疫荧光染色:在治疗前(基线)和新辅助治疗后(手术时)收集组织样本。
流式细胞术和酶联免疫吸附测定:在新辅助治疗前(基线)和治疗后(术前)采集血液样本。

研究结果
从2021年12月到2023年12月,共有35名患者经过筛选并符合分析条件,中位年龄为67岁(范围61-73岁)。大部分患者为男性(27人,77%)且患有IV期疾病(31人,89%)。五名患者因不可切除(3人,9%)或严重并发症(2人,6%)未接受手术,最终,30名患者接受了手术。

近期疗效
经过新辅助放化疗联合尼妥珠单抗和卡瑞利珠单抗(NCRCN)治疗后,35名患者中有31名(89%)实现了30%或更大的肿瘤缩小;手术转化率为86%(30/35);R0切除率为97%(29/30)。
30名患者中有11名(37%)为肿瘤消退分级(TRG)1级,10名(33%)为TRG2级,3名(10%)为TRG3级,4名(13%)为TRG4级,2名(7%)为TRG5级。
病理完全缓解(pCR)率和主要病理缓解(MPR)率分别为37%(11/30)和53%(16/30)。
远期疗效
中位观察时间18.5个月后,整个队列的1年和2年PFS率分别为67%和40%;整个队列的1年和2年OS率分别为80%和64%;整个队列的中位PFS为21.3个月,中位OS未达到。
分别有4名患者(11%)出现局部区域复发,4名患者(11%)出现脑或肺转移,4名患者(11%)同时出现局部区域复发和远处转移。

安全性
最常见的1-2级不良事件是疲劳(94%,33/35)、放射性皮炎(86%,30/35)、食管炎(69%,24/35)、中性粒细胞减少(40%,14/35)以及恶心或呕吐(31%,11/35)。3级以上的主要不良事件是淋巴细胞减少(77%,27/35)、放射性食管炎(17%,6/35)、肝功能异常(11%,4/35)和中性粒细胞减少(9%,3/35);特别需要密切监测皮疹(4级)这一免疫相关不良事件,一名患者出现吻合口瘘,两名患者出现食管瘘,未发生其他4级或5级治疗相关不良事件。

探索性分析
为了探索肿瘤微环境的潜在免疫生物标志物,在新辅助治疗前后收集了配对活检(n = 17)和血浆(n = 20)样本。多重免疫荧光染色显示,新辅助治疗后肿瘤微环境中CD8 +T细胞、GZMB+CD8 +T细胞浸润增加,FOXP3 +Treg细胞密度降低(图A-B);间质中CD4 +T细胞、FOXP3 +Treg细胞和TIM3 +CD8 +T细胞密度在新辅助治疗后降低(图B)。
新辅助治疗后达到pCR的患者显示肿瘤微环境中FOXP3 +Treg细胞浸润减少,CD8 +T细胞密度变异上调(P<0.05)。间质微环境中的免疫细胞群均与pCR无显著相关性(P>0.05)。
肿瘤中CD8 +T细胞密度的高变异与更好的PFS显著相关(HR, 7.69; 95 %CI, 1.41–41.72; P=0.01,图C)。但所有免疫细胞指标对总生存期均无显著改善(均P>0.05,图C)。与新辅助治疗前基线相比,治疗后血浆中的CD8 +T细胞和IFNγ显著升高(P<0.05,图E)。与非pCR组相比,新辅助治疗后达到pCR的患者的CD8 +T细胞和IFNγ变异增强(图F)。

讨论
本研究是一项前瞻性Ⅱ期试验,报告了新辅助放化疗联合卡瑞利珠单抗和尼妥珠单抗(NCRCN)方案在初始不可切除LAESCC患者中的疗效、安全性和潜在免疫生物标志物。研究达到了主要终点,1年PFS率为67%。值得注意的是,NCRCN方案有效,手术转化率达到86%,这可能是目前我们所知的最高报道。
初始不可切除食管癌患者的标准治疗是根治性CRT,尽管其与高复发率和低长期生存率相关。对于初始不可切除的LAESCC,结合免疫治疗和/或靶向治疗且具有高手术转化率的多模式治疗可能是一种有前景的策略。新近报道的NEXUS-1试验显示,66.7%(20/30)的不可切除ESCC患者通过使用强效转化放化疗及随后两个周期的免疫化疗获得了手术机会。在本研究中,NCRCN方案具有更高的手术转化率,高达86%(30/35)。在放化疗中加入卡瑞利珠单抗和尼妥珠单抗可能因其协同效应而贡献了卓越的表现,理论上可以利用和增强CRT反应。
在近期报告中,在新辅助CRT中加入免疫治疗在可切除ESCC中实现了更显著的病理反应,pCR率超过50%;然而,新辅助CRT加免疫治疗在初始不可切除LAESCC中的病理反应尚未得到充分阐明。本研究中的pCR率仅为31%,低于NEXUS-1研究意向性治疗(ITT)人群的43.3%,这种差异可能归因于大多数参与者为IVA期疾病,在本研究中,IVA期疾病患者的比例为89%。此外,本研究入组的所有患者均患有cT4原发肿瘤和/或侵犯邻近结构的淋巴结转移。与本研究相比,NEXUS-1研究是一项创新设计,在CRT和手术之间插入了免疫化疗,显示出良好的疗效。更强烈的全身治疗和增加的放疗剂量(50 Gy)可能是其他因素。然而,在现实世界中,大多数患者是否能耐受如此强烈的治疗方案(根治性CRT加免疫化疗)以获得手术机会是值得怀疑的。
在生存获益方面,1年PFS率是本研究主要终点,本研究达到了主要终点,ITT人群的1年PFS率为67%。值得注意的是,在本研究中实现可切除性的患者中,1年PFS率和1年OS率均约为80%,这与NEXUS-1研究相似。本研究和NEXUS-1的短期(1-1.5年)生存获益等同于针对可切除局部晚期食管癌的新辅助CRT,例如5010试验和CROSS试验。
此外,先前的一项回顾性研究显示,接受新辅助CRT和序贯手术治疗的初始不可切除患者的1年PFS率接近50%,基于上述研究,新辅助CRT加免疫治疗和/或抗EGFR靶向治疗随后手术可能是不可切除LAESCC的一种有前景的治疗策略;在随访期间,百分之五十的患者经历了治疗失败(远处转移 vs 局部复发 vs 两者兼有:26% vs 10% vs 14%),这高于本研究的34%;这些结果表明NCRCN方案可能提供更多的手术转化机会,且复发率低。
研究结论
新辅助放化疗联合尼妥珠单抗和卡瑞利珠单抗(NCRCN)方案在初始不可切除的LAESCC患者中显示出令人鼓舞的抗肿瘤活性和高手术转化率。NCRCN方案的疗效和安全性需要在更大规模、前瞻性、多中心研究中得到证实。








